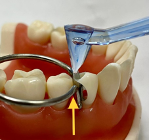
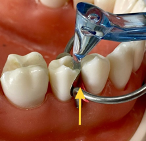
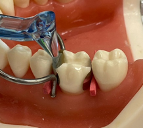
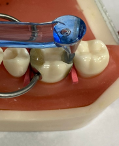
Контакты
Адрес:
г. Санкт-Петербург, ул. Салова, 34И
Мы работаем:
С понедельника по пятницу, с 9:00 до 18:00 (время Московское)
Юридическая информация о компании:
ООО «АКЦЕНТ»
ИНН 7802713721
Юр. адрес: 194355, г. Санкт-Петербург, Выборгское ш., 23, лит. А, пом. 62 Н
ИНН 7802713721
Юр. адрес: 194355, г. Санкт-Петербург, Выборгское ш., 23, лит. А, пом. 62 Н
Связаться с нами
Вы можете задать свой вопрос в форме ниже. Мы обязательно ответим вам в течение одного рабочего дня.
Отправить заявку
Ваша заявка отправлена!
Мы созвонимся с вами в ближайшее время!
Мы созвонимся с вами в ближайшее время!